В начале 1980-х годов американский инженер Чарльз Халл сконструировал первый 3D-принтер, способный создавать твердые объекты с помощью так называемой системы автоматизированного проектирования. В основе работы принтера лежала революционная для того времени технология стереолитографии. Она заключалась в нанесении последовательных слоев фотополимера на акриловой основе, которые, под воздействием УФ-излучения, формировали твердый трехмерный объект. К концу 1990-х 3D-печать нашла применение в здравоохранении, преимущественно, в хирургии для 3D-печати зубных имплантатов, протезов и даже мочевого пузыря. Внедрение технологии в медицинскую практику дало начало новому направлению – «3D-биопечати». При данном виде 3D-печати материал, называемый «биочернилами», состоял из живых клеток, биоматериалов или активных биомолекул. Технология метода была аналогична стандартному подходу и включала в себя послойное нанесение биочернил для создания 3D-структур, таких как ткани и органы [1].
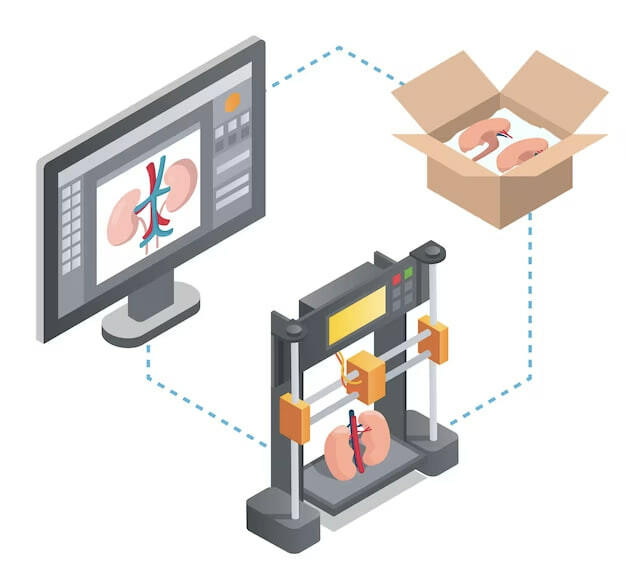
3D-биопечать включает в себя построение ткани или органа слой за слоем по направлению «снизу вверх». Одним из ключевых компонентов 3D-биопечати являются биочернила. Они состоят из биоматериалов, таких как живые клетки, биомолекулы и другие вспомогательные элементы. Живые клетки или биомолекулы печатаются непосредственно на подложке по определенному шаблону, так что они могут держаться вместе, образуя 3D-конструкцию (Рис. 1). Успешность процедуры требует строгого соблюдения условий печати, в частности, учета биосовместимости используемого материала, чувствительности клеток к методам печати, использование факторов роста и перфузии и др. Цель 3D-биопечати заключается в максимальном воспроизведении естественной клеточной архитектуры и, в конечном счете, структуры и функциональности сложных тканей.
.png)
Рисунок 1. Процесс 3D-биопечати включает три основных этапа: подготовительный этап, этап печати и постобработка. Подготовительный этап – это проектирование анатомически точных 3D-моделей с помощью программного обеспечения для компьютерной графики и преобразование их в стопку 2D-слоев заранее определенной оператором толщины, которые будут загружены в биопринтер для печати. Этот шаг также включает в себя выбор материала или биочернил. Этап печати включает фактическую печать тканей с помощью методов аддитивного производства. Постобработка подразумевает созревание изготовленной конструкции в ходе биореакции и оценку ее структурных и функциональных характеристик.
Сегодня эта технология используется для изготовления функциональных тканей и органов человека, таких как сердце, печень, кожа, кости и др. В будущем ожидается применение 3D-биопечати для создания моделей органов на микрофлюидных чипах («орган-на-чипе») [2]. Последние представляют собой объекты, имитирующие живой человеческий орган. Эти конструкции могут представлять собой не только отдельные органы, но и целые процессы, протекающие в организме. Разработка таих систем позволит совместить исследования in vitro и in vivo и откроет новые возможности для биомедицинских и фармакологических исследований, в том числе для тестирования лекарств [3].
Ученые из Томского государственного университета планируют использовать методы 3D-биопечати для изучения различных заболеваний. Усовершенствованные методы позволяют выделять клетки с патологическим строением из биоматериалов пациентов, культивировать их в лабораторных условиях и использовать для печати тканей. Полученные на 3D-биопринтере ткани позволят исследователям тестировать новые препараты, исключив таким образом из клинических испытаний исследования на лабораторных животных. Дополнително планируется внеднение метода в разработки в области редактирования врожденного иммунитета для предотвращения образования метастазов онкологичесих заболеваний.
Применение 3D-биопечати не ограничивается печатью органов. Метод имеет большие перспективы в менее изученных областях, таких как создание носителей для доставки терапевтических препаратов (например, содержащий рифампицин каркас для лечения остеомиелита), моделирование механизмов развития заболеваний или создание персонализированных лекарств с индивидуально подобранными профилями высвобождения действующего вещества [3].
Несмотря на преимущества и возможности 3D-биопечати, современная технология не лишена недостатов. Например, нерешенной проблемой до сих пор остается васкуляризация ткани, газообмен и питательный обмен, биосовместимость и биоразлагаемость материала, который используется в качестве субстрата, а таже форма объекта и сохранение функциональности печатной ткани. Решением этих проблем может стать применение синтетических и природных полимеров, такие как альгинат, желатин, коллаген, полиэтиленгликоль, гидроксиапатит и др. Их преимущество заключается в хорошей биосовместимости и контролируемых физико-химических свойствах, которые можно модифицировать в соответствии с конкретной задачей [2].
Материал подготовлен в рамках проекта «Медицина в точке бифуркации». Проект поддержан грантом Минобрнауки России в рамках федерального проекта «Популяризация науки и технологий»
Список литературы
- Dey M., Ozbolat I.T. 3D bioprinting of cells, tissues and organs. Sci Rep. 10, 14023. 2020. DOI:0.1038/s41598-020-70086-y
- Agarwal S., Saha S., Balla V.K., Pal A., Barui A. and Bodhak S. Current Developments in 3D Bioprinting for Tissue and Organ Regeneration–A Review. Front. Mech. Eng. 6, 589171. 2020. DOI:10.3389/fmech.2020.589171
- Афоничева П.К., Буляница А.Л., Евстрапов А.А. "Орган-на-чипе" – материалы и методы изготовления (обзор) // НП. №4. 2019
.jpg)